
日前,生物城企业迈克生物股份有限公司(以下简称“迈克生物”)宣布,其研发的6项化学发光试剂产品获得欧盟公告机构BSI、南德TÜV SÜD签发的IVDR CE证书。
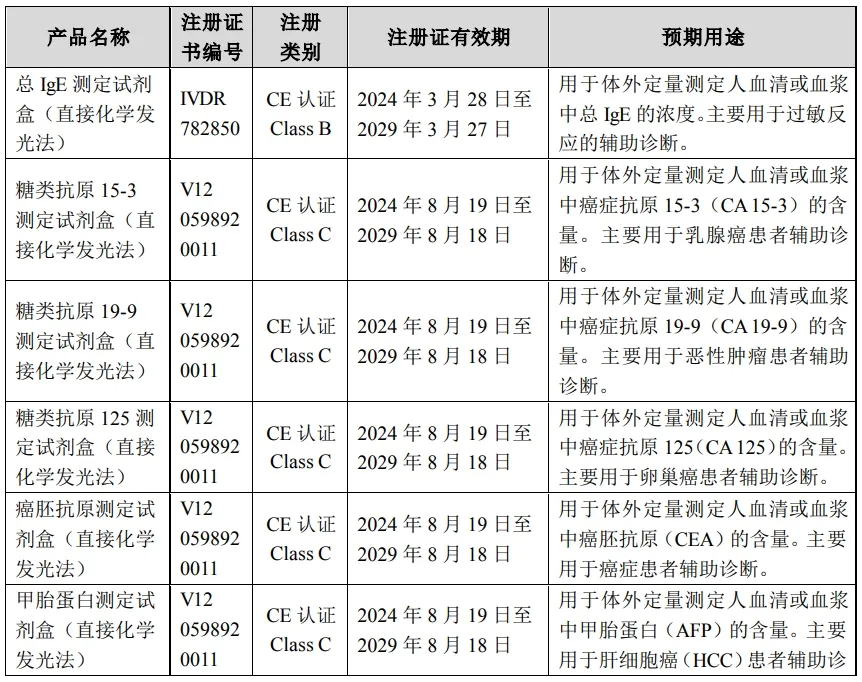
其中: ▻ 总IgE测定试剂盒(直接化学发光法)主要用于过敏反应的辅助诊断; ▻ 糖类抗原15-3测定试剂盒(直接化学发光法)、糖类抗原19-9测定试剂盒(直接化学发光法)、糖类抗原125测定试剂盒(直接化学发光法)、癌胚抗原测定试剂盒(直接化学发光法)、甲胎蛋白测定试剂盒(直接化学发光法)是常见的5项肿瘤标志物检测项目,主要用于恶性肿瘤及相关癌症的辅助诊断。 根据欧盟体外诊断医疗器械法规的规定,取得IVDR CE证书的产品已经具备进入欧盟市场的必要条件。 截至目前,迈克生物在直接化学发光技术平台下已累计取得109项试剂类产品注册(涵盖甲状腺功能、传染病、心肌、肿瘤标志物、贫血、炎症、自身免疫性疾病、生殖激素、骨代谢等病种检测)。
此次连获6张IVDR CE证书,将有助于提升迈克生物海外市场综合竞争力,拓展海外市场。
了解更多»»» 迈克生物 迈克生物专注于体外诊断产品的研发、生产、销售和服务,是经国家相关部门认证的“高新技术企业”, 拥有专业的研发、生产和管理运营团队。目前,迈克生物已完成从生物原材料、医学实验室产品到专业化服务的全产业链发展布局。具备研发制造体外诊断设备、试剂、校准品和质控品的系统化专业能力,产品涵盖生化、免疫、凝血、输血、血球、尿液、分子诊断、病理等技术平台。
随着生物城产业创新成果竞相涌现,越来越多的创新医药器械产品开始踏上出海征程。2023年,康诺亚就其首创药CMG901与阿斯利康签订12亿美元全球独家许可协议,成为首个在中国及美国均取得临床研究申请批准的靶向Claudin 18.2的全新重组人源化单克隆抗体偶联药物;
2023年,苑东生物全资子公司硕德药业开发的阿片拮抗类药物“盐酸纳美芬注射液”获得美国FDA签发的上市批准通知; 2024年2月,汇宇制药多西他赛注射液、注射用盐酸苯达莫司汀、唑来膦酸注射液三款产品在埃及获批上市。 ……
接下来,生物城将加快推进产业建圈强链,瞄准企业创新品种研发生产等关键环节和重点领域,培育形成新的增长点和竞争新优势;同时搭建多元交流平台,助力国际交流合作,加速园区生物医药技术、产品“走出去”,为企业发展创造新机遇注入新动能,进一步推动生物医药产业高质量发展。






